考点一 质量守恒定律
2.内容:参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。 (1)质量守恒定律只适用于化学变化;强调的是质量守恒,不适合体积守恒。 (2)没有参加反应的物质质量(反应物过量和催化剂等)和与反应无关的物质质量不计在总和中。 (3)有气体或沉淀参与反应时,质量也不能忽略。 3.微观解释:在化学反应前后,原子的种类没有改变,数目没有增减,质量也没有改变,所以物质的总质量不变。
(4)书写步骤 写:根据事实写出反应物和生成物的化学式; 配:在化学式前面配上适当的化学计量数,使反应前后各原子的_种类_、_数目_相等; 注:注明化学反应的反应条件; 标:如果只有生成物中有气体,在气体物质的化学式右边要注“↑”号;溶液中的反应如果生成物中有固体,在固体物质的化学式右边要注“↓”号;如果反应物中也有气体或不溶性固体,则不用注明。
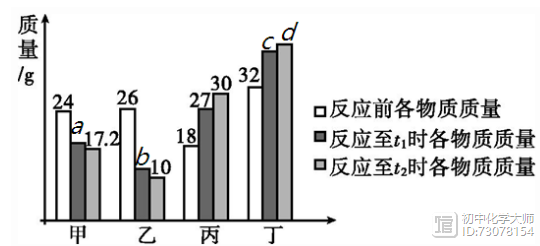
【注意】 ①所写化学方程式必须配平,然后才能代入数据计算。 ②相关物质的相对分子质量与化学计量数的乘积、已知量、未知量要写在对应物质化学式的下面。 ③代入化学方程式的量必须是纯净物的质量。 ④代入的数据都是一个完整的物理量,即所设未知数后不带单位,代入的已知量及求得的未知量均带单位。 1. [2019·潍坊]在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中两个时刻各物质的质量如图12-1所示,图中a、b、c、d分别表示相应物质的质量。下列说法正确的是( ) A.b的数值为14 B.该反应为复分解反应 C.反应过程中乙与丁发生改变的质量比为5:6 D.充分反应后生成丙的质量为37.5 g
[解析]根据题意有(26-b):(27-18)=(26-10):(30-18),b=14;反应后甲、乙质量减小,是反应物,丙、丁质量增大,是生成物,但是不能判断各种物质的种类,即不能判断是单质还是化合物,因此反应不一定是复分解反应;d=24+26+18 +32-17.2-10-30=42.8,反应过程中乙与丁发生改变的质量比为 (26-10):(42.8-32)=40:27;由图中数据可知,充分反应后生成丙的质量为30 g-18 g =12 g。
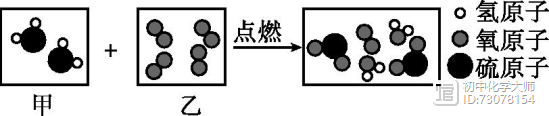
【方法点拨】书写化学方程式的题型一般分两类:第一类是基本型,取材于教材;第二类是信息给予型。不管哪种形式,解决这类题的关键是要认真阅读、收集、处理信息,找出反应物、生成物和反应条件,再结合化学方程式的书写方法进行答题。 4. [2019·苏州]如图12-2是某反应的微观示意图。下列说法不正确的是( ) A.反应后硫元素化合价升高 B.生成物均为氧化物 C.反应后分子总数减少 D.参加反应的甲、乙分子个数比为1:2
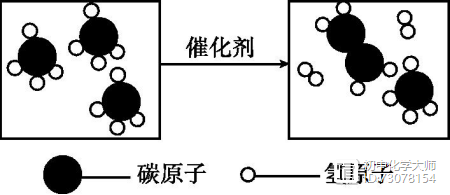
[解析]由微观反应示意图可知,该反应是由硫化氢与氧气在点燃的条件下反应生成二氧化硫和水,化学方程式为:2H2S+3O2=2SO2+2H2O。硫元素由-2价变为+4价,反应后硫元素化合价升高,A正确;生成物是二氧化硫和水,均为氧化物,B正确;由化学方程式可知,反应后分子总数减少,C正确;由化学方程式可知,参加反应的甲、乙分子个数比为2:3,D不正确。 5. [2019·攀枝花]我国科学家合成了一种特殊的催化剂,使甲烷高效转化为乙烯获得重大突破,微观示意图如下。
图12-3 图示中属于单质的物质名称是 ,图示所表示反应的化学方程式为 ,该反应属于基本反应类型中的 反应。 [解析]由图可知,属于单质的物质是 ,名称是氢气;甲烷在催化剂的作用下分解生成乙烯和氢气;该反应符合“一变多”的形式,属于分解反应。
|