我们知道溶解度曲线是反映物质溶解度随温度变化关系的曲线,它是用实验方法测出某物质在各种温度下的溶解度数值,运用直角坐标作图方法绘制出来的,其中纵坐标表示溶解度(以克为单位),横坐标表示温度(℃)。溶解度曲线中的点、线、面都有其特定的物理意义和用途。因此,本文以KNO3和NaCl的溶解度曲线为例,对溶解度曲线中点、线、面的意义和作用作如下讨论,供同学们学习时参考。
一、溶解度曲线上的点
平面直角坐标上每一点都有特定的意义,例如,溶解度曲线上任意一点表示在该温度下KNO3和NaCl的溶解度,即在该温度时某物质饱和溶液的组成。
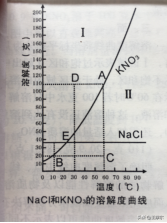
1.溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
A点表示60℃时KNO3饱和溶液,其溶解度为110克,即表示在60℃时100克水中最多可溶解110克KNO3固体。
B点表示10℃,KNO3的溶解度为20.9克,即该温度时100克水中最多可溶解20.9克KNO3。
2.溶解度曲线下方面积内的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应温度时的不饱和溶液。
C点表示在60℃时100克水中只溶解了20.9克KNO3,所得溶液为不饱和溶液,若要使此溶液达饱和,还需加入适量溶质KNO3(110-20.9=89.1克)。
3.溶解度曲线上方面积内的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
D点表示在30℃时,100克水中溶解了110克KNO3(假设可能),此时的溶液为过饱和溶液;由于过饱和溶液不稳定,只要条件稍微变化,便会析出晶体(110—45.8=64.2克)。
4.两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
E点为NaCl和KNO3溶解度曲线的交点,表示在22℃时KNO3和NaCl的溶解度相等,均为36克。
二、溶解度曲线图上的线
曲线是由无数个点组成的,每一种物质都有一条对于应的曲线,它是物质在各对应温度时的溶解度的集合,其对应的溶液均为饱和溶液。
每一条曲线都表示这种物质的溶解度随温度变化而变化的总趋势,主要有:
1、陡升型:绝大多数固体物质的溶解度随温度的升高而增大,曲线陡峭。代表物质有KNO3、NH4NO3等。
2、缓升型:少数固体物质的溶解度受温度的影响较小。代表物质有NaCl。
3、下降型:极少数固体物质的溶解度随温度的升高而减小。代表物质有Ca(OH)2。
三、溶解度曲线图上的面
溶解度曲线将坐标平面分为几个区域。
1、在溶解度曲线上方平面上的区域:表示在该点所示温度下形成了含有部分固体溶质的饱和溶液,即按照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是饱和溶液,或者是过饱和溶液,且还有未溶解完的溶质存在。
对KNO3的溶解度曲线而言,
上图Ⅰ区域表示过饱和区(超出中学要求,不进行讨论)。
2、在溶解度曲线下方平面上的区域:表示在该点所示温度下形成了不饱和溶液,即按照该点所示温度和溶质质量,在100g溶剂中配制得到的溶液是不饱和溶液。
上图Ⅱ区域表示不饱和区,处于该区域内的溶液均为不饱和溶液。例如,C点表示在60℃时若100克水中只溶解了20.9克KNO3,所得溶液为不饱和溶液,这种溶液还没有达到溶解平衡状态。若要使此溶液达到饱和,还需加入适量的溶质KNO3。
(110克-20.9克=89.1克)
四、溶解度曲线图的综合应用
明确了溶解度曲线中点、线、面所表示的意义,可以帮助我们了解物质的溶解性能以及物质溶解度随温度的变化而变化的情况,从而应用溶解度曲线来分析解决有关的化学问题。
现举例如下:
1、溶解度曲线上的每一点都代表着对应温度下该物质的溶解度,所以利用溶解度曲线可以查找出某种物质在不同温度时的溶解度。
从KNO3溶解度曲线图中可以查出:10℃时KNO3的溶解度为20.9克,30℃时为45.8克,50℃时为85.5克。
2、根据溶解度曲线的走向,可以判断或比较各物质的溶解度随温度变化的趋势。
溶解度曲线可以表示温度对溶解度的影响,比较不同物质在某一温度时溶解度的大小。由KNO3和NaCl溶解度曲线可以看出:
(1)KNO3的溶解度曲线比NaCl溶解度曲线斜率变化大,其溶解度受温度的影响也较大,溶解度的数值随温度的升高而增大。
(2)NaCl的溶解度曲线的斜率变化较小,温度的变化对其溶解度的影响也较小。
(3)NaCl和KNO3比较,温度的变化,对KNO3的溶解度的影响比对NaCI溶解度的影响大。
3、通过溶解度曲线,可以比较不同物质溶解度的大小。从上图知:
(1)当温度高于22℃时,KNO3的溶解度大于NaCl的溶解度。
(2)当温度低于22℃时,KNO3的溶解度小于NaCl的溶解度。
(3)当温度等于22℃时,两条曲线相交,此时二者的溶解度相等。
4、运用溶解度曲线,可以找出由不饱和溶液转化为饱和溶液的方法。如图中C点代表60℃时,20.9克KNO3溶于100克水中的不饱和溶液,要使此溶液变饱和,从图中可以直观地判断,应由C点沿与坐标轴平行的方向向溶解度曲线趋近。当溶剂量保持不变时,可以采用以下两种方法:
(1)保持温度恒定(仍为60℃),加入溶质KNO3(110—20.9=89.1克)使之饱和。
(2)保持溶质质量不变(仍为20.9克),降低温度到10℃。
若要保持温度不变又不增加溶质,则可采用第三种方法——蒸发溶剂。所蒸发溶剂的质量也可以根据溶解度曲线所提供的数据进行计算;本例C点的溶液,通过计算,蒸发去溶剂81克即可使溶液达到饱和。计算过程为:
100∶110=x∶20.9
解得:x=19
100-19=81(克)
5、利用固体溶解度随温度变化的不同,可以进行物质的分离和提纯,等等。
综上所述,溶解度曲线这个物质溶解度的图象表述,在溶液知识中占有十分重要的地位。因此,掌握溶解度曲线的绘制、应用好其中点、线、面的意义,对于学好初中化学溶液知识是非常有帮助的。
