初中化学物质构成的奥秘11大考点,全是中考重点!
2025-04-26 16:30
来源:
文化之窗
本文影响了:432人
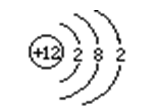
⒉在原子里,核电荷数=质子数=核外电子数,原子不显电性。
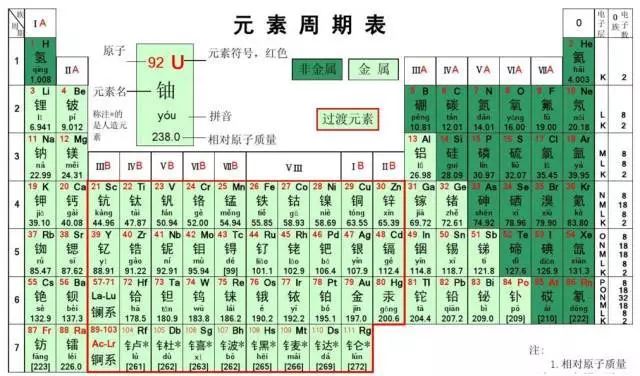
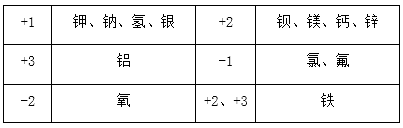
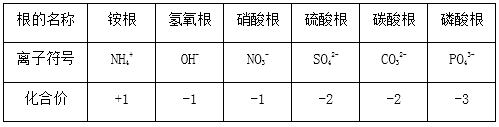
⒈相对原子质量的标准:碳-12原子质量的1/12。⒉表达式:Ar=其他原子的质量/(碳-12的质量×1/12)⒊原子的质量主要集中在原子核上,相对原子质量≈质子数+中子数⒈元素的定义:具有相同核电荷数(即核内质子数)的一类原子的总称。⒊地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。⒈元素符号:用元素的拉丁文名称的第一个大写字母来元素。⑴由一个字母表示的元素符号要大写,如:H、O、S、C、P等。⑵由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”),如:Ca、Na、Mg、Zn等。⒊元素符号表示的意义:⑴表示一种元素;⑵表示这种元素的一个原子。例如:注意:元素只讲种类,不讲个数;原子即讲种类,又讲个数。如:水分子是由氢原子和氧原子构成的;每个水分子是由二个氢原子和一个氧原子构成的。⑵周期表每一个纵行叫做一族,共有16个族(8、9、10三个纵行共同组成一个族)。⑶由于在元素周期表中位置越靠近的元素,性质越相似,可以启发人们在元素周期表的一定区域寻找新物质(如农药、催化剂、半导体材料等)。⒈电子排布——分层排布:第一层不超过2个;第二层不超过8个;……最外层不超过8个。②原子最外层电子数为8(氦为2)的结构称为稳定结构。⒊离子符号表示的意义:表示离子(或一个离子),如:Mg2+——表示镁离子(一个镁离子)⑴离子符号前面的化学计量数(系数)表示离子的个数;⑵离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。离子带1个单位的正电荷或个单位的负电荷,“1”省略不写。如:阳离子:Na+、Ca2+、Al3+等,阴离子:Cl-、S2‑等⑴双原子分子的化学式,如:氢气——H2,氧气——O2,氮气——N2,氯气——Cl2。⑵稀有气体、金属与固体非金属单质:由原子构成,它们的化学式用元素符号来表示。正价写左边,负价写右边,同时正、负化合价的代数和为零。⑴一种物质只有一个化学式,书写化学式时,要考虑到元素的排列顺序,还要考虑到表示原子个数的角码应写的部位。⑵一般化合物的中文名称,其顺序和化学式书写的顺序正好相反。表示该物质由哪些元素组成:表示二氧化碳由碳元素和氧元素组成。表示分子的构成:表示每个二氧化碳分子由一个碳原子和二个氧原子构成。化合价用+1、+2、+3、-1、-2……表示,标在元素符号的正上方,如:Na、 Cl、 Mg、 O。要注意化合价的表示方法与离子符号的区别,离子所带电荷符号用+、2+、-、2-……表示,标在元素符号的右上角,如:⑴氢元素的化合价通常显+1价,氧元素的化合价显-2价。⑶非金属与氢或金属化合时,非金属元素显负价;非金属与氧元素化合时,非金属元素显正价。一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;⒈计算物质的相对分子质量=各元素的相对原子质量×原子个数之和⒉计算物质组成元素的质量比=各元素的相对原子质量×原子个数之比物质中某元素的质量分数=(该元素的相对原子质量×原子个数)÷化合物的相对分子质量×100%某元素的质量=化合物的质量×化合物中该元素的质量分数变形:化合物的质量=某元素的质量÷化合物中该元素的质量分数⒌已知化合物中各元素的质量比和各元素的相对原子质量,求原子个数比各元素的原子个数比=各元素的质量/各元素的相对原子质量之比
![]()