一、氢氧化钠变质的探究
1.变质的原因
氢氧化钠与空气中的CO2发生反应:CO2十2NaOH=Na2CO3 +H2O (用化学方程式表示)。氢氧化钠应密封保存。
成分分析
1没有变质:NaOH
2部分变质:NaOH和Na2CO3
3全部变质:Na2CO3
3.是否变质的探究(实质是检验是否已有CO32- )
(1)思路分析:检验CO32-时,选择的试剂能和CO32-反应产生明显现象,但不能和OH-反应产生同样的现象。
CO32-与H+ :产生气泡
CO32-与Ca2+、Ba2+ :产生白色沉淀
(2)加酸,加入过量的稀酸(或稀硫酸),若有气泡产生,证明NaOH已变质
(3)加碱:Ca(OH)2溶液、Ba(OH)2溶液
(4)加盐:BaCl2溶液、 CaCl2溶液、 Ca(NO3)2溶液、 Ba(NO3)2溶液
讨论:如何从部分变质的氢氧化钠溶液中得到纯净的氢氧化钠溶液?
去除Na2CO3(NaOH与Na2CO3 转化)
Na2CO3+ Ca(OH)2 →CaCO3↓+2NaOH
Na2CO3+ Ba(OH)2 →BaCO3↓+2NaOH
1、 做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生。
小伟提醒:是不是拿错了药品?我查验后确认药品没错,只是在瓶口发现有白色粉末状物质。
我认为是氢氧化钠溶液变质了。
针对该问题我进行了以下分析,请你和我共同来完成。
(3)利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质。请你帮我完成。
实验步骤 | 实验现象 | 实验结论 |
取少量氧氧化钠溶液于试管中,滴加氯化钙溶液 | 有白色沉淀 | 该氢氧化钠 溶液已变质 |
(4)该氢氧化钠溶液是部分变质还是全部变质?
实验步骤 | 实验现象 | 实验结论 |
①取少量氧氧化钠溶液于试管中,滴加足量CaCl2溶液 ②取①所得溶液于试管中,向其中滴加酚酞。 | ① 有白色沉淀 ②溶液变红 | 该氢氧化钠 溶液部分变质 |
思考:如果是固体NaOH部分变质,还能用它来配制NaOH溶液吗?
操作 | 现象 |
1.将部分变质的NaOH固体倒入烧杯中,加水使其全部溶解。 | 无色溶液 |
2.向烧杯中加入氯化钙溶液,直至不再产生沉淀为止。 | 产生白色沉淀 |
3.将2中溶液静置后过滤。 | 沉淀留在滤纸上,得无色滤液 |
2、氢氧化钙俗称熟石灰和消石灰,其水溶液俗称石灰水,其溶液露置至于空气中瓶壁会出现白色固体碳酸钙,可用稀盐酸洗去这种白色固体,原因是CaCO3+2HCl→CaCl2+H2O+CO2↑
实例精选
1某长期暴露在空气中的氢氧化钠样品,如果向其中滴加盐酸,盐酸滴加到一定量后有气泡产生,加入稀盐酸的质量与产生的二氧化碳的量的关系如图所示。下列说法正确的是( )
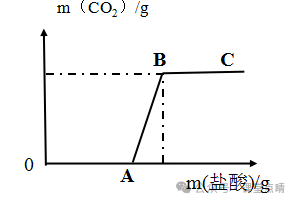
A、A点表示盐酸恰好完全反应
B、该溶液已变质
C、整个过程中发生的中和反应
D、该溶液是氢氧化钠的饱和溶液
答案 B
2 盛有氢氧化钾溶液的烧杯中,滴加两滴石蕊试液,液体立即呈现蓝色,将此溶液长期露置空气中,溶液的pH值将变小(填“变大”、“变小”或“不变”)。用化学方程式表示其原因2KOH+CO2→K2CO3+H2O
