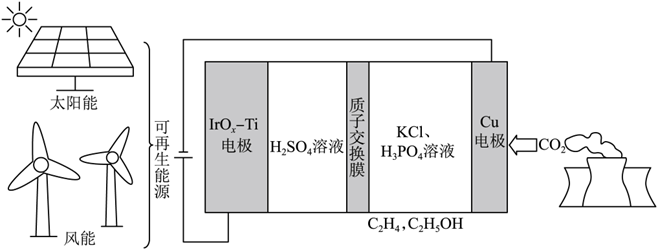
1.(2023·全国甲卷)用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是
A.析氢反应发生在电极上
B.从电极迁移到电极
C.阴极发生的反应有:
D.每转移电子,阳极生成气体(标准状况)
答案:C
解析:
根据题意,由可再生能源(太阳能或风能)提供电能,通过直流电源电解,题中电解池装置可转化为基本模型,质子交换膜将溶液分为左右两个区域,右侧铜电极为阴极,与电源负极相连,通入CO2气体后,被还原为有机物,左侧Ti电极为阳极,与直流电源正极相连,水被氧化产生氧气。
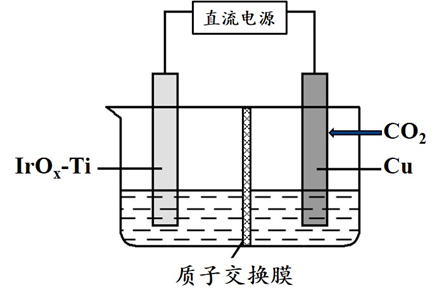
在装置右侧将CO2还原为有机物,右侧为阴极区,CO2在Cu电极上得电子,还原为有机物,该区域溶液为酸性;分析化合价,规定H为+1价,O为-2价,则CO2中C为+4价,C2H4中C为-2价,C2H5OH中C为-2价。左侧为阳极区,H2O在电极上失电子被氧化产生O2,左侧区域溶液为酸性,
2CO2+ 12e- + 12H+=== C2H4 + 4H2O
2CO2+ 12e- + 12H+=== C2H5OH + 3H2O
H2O在电极上被氧化产生O2,不发生析氢反应,A选项错误;
由于装置中为质子交换膜,左侧产生左侧反应产生H+,右侧反应消耗H+,则左侧溶液中的H+通过质子交换膜进入右侧,B选项错误;
右侧为阴极区,该区域溶液为酸性,CO2在Cu电极上得电子,还原为有机物(乙烯或乙醇),半反应正确,C选项正确;
左侧为阳极区,H2O在电极上失电子被氧化产生O2,其半反应为:2H2O -4e-=== O2+ 4H+,则失去4e-反应产生1分子O2,转移1 mol e-,则产生0.25 mol O2(标况下为5.6 L),D选项错误。
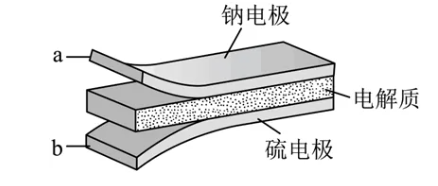
2.(2023·全国乙卷)室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-→S,S+e-→S,2Na++S+2(1-)e-→Na2Sx
下列叙述错误的是
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e-→Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
答案:A
解析:
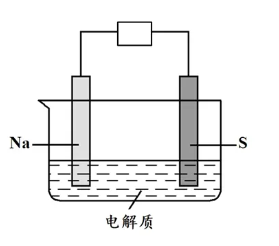
根据题意,可以将电池装置转化为下图电池基本模型,分别以Na、S作为电极材料,电解质只提供导电环境,不参与电极反应(电解质不含水,避免Na反应),反应时,Na被氧化而S被还原。
其电池总反应可表示为:![]()
负极半反应为:2Na -2e- ===2Na+;
正极半反应为:xS8+ 2e- + 2Na+ ===Na2SX
放电时作为电池,Na电极反应产生Na+,离子从Na电极向S电极移动,则充电时,S电极释放Na+,离子从S电极向Na电极移动,A选项错误;
根据电池总反应,放电时,Na失去电子而S得到电子,电子从Na电极沿导线向S电极移动,即a→b,B选项正确;
根据电池的正极半反应判断,C选项正确;
由于硫磺作为非金属单质,导电性差,使用炭化纤维素纸上喷涂硫磺作为电极材料,纤维素炭化产生炭黑(石墨具有良好的导电性),可以增强电极的导电性,D选项正确。
3.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH)存在]。电池放电时,下列叙述错误的是( )
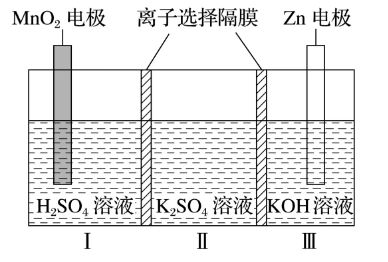
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+2e-+4H+===Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+===Zn(OH)+Mn2++2H2O
答案:A
解析:
根据题意,该电池装置中,在Ⅲ区,Zn失电子发生氧化反应,Zn作为负极,负极半反应为:Zn – 2e- + 4OH- === Zn(OH)42- ;
根据负极半反应可知Ⅲ区阴离子减少,若Ⅱ区与Ⅲ区之间的离子交换膜为阳离子交换膜(允许阳离子通过),则K+从Ⅲ区向Ⅱ区移动,若离子交换膜为阴离子交换膜(允许阴离子通过),则SO42-从Ⅱ区向Ⅲ区移动,A选项错误;
在Ⅰ区,MnO2得电子发生还原反应,MnO2做正极,正极半反应为:
MnO2+ 2e- + 4H+ === Mn2++ 2H2O,由半反应可知,Ⅰ区阳离子减少,
若Ⅰ区与Ⅱ区之间的离子交换膜为阳离子交换膜,则K+从Ⅱ区向左移动进入Ⅰ区,若为阴离子交换膜,则SO42-从Ⅰ区向右进入Ⅱ区,B选项正确;
根据正极半反应可知C选项正确;
则总反应为:Zn+4OH-+MnO2+4H+===Zn(OH)+Mn2++2H2O,D选项正确;
