实验事实:钠能与水反应产生H2,反应剧烈,明显放热甚至会引发燃烧,钠也能与乙醇反应产生H2,反应较缓慢,放热不明显; 结论:乙醇具有酸性,且乙醇的酸性比水弱; 应用:可以用乙醇来处理实验后的废钠。 解释:根据PKa数据可以判断酸性强弱,PKa越大则酸性越弱,查阅数据可知,25℃时,PKa(H2O)=15.7,PKa(乙醇)=15.9,即乙醇的酸性比水弱。
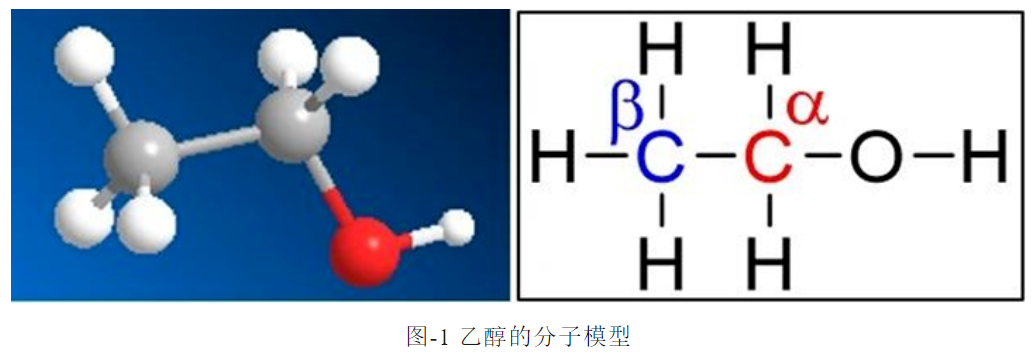
乙醇分子中含6个H原子,由于电负性O(3.5)>C(2.5)>H(2.2),O-H键的极性比C-H键极性更明显,所以分子中C-H键很难断裂,而羟基中O-H键容易断键电离出H+,金属钠与溶液中H+的反应产生H2,
化学方程式的书写:类比钠与盐酸、与水的反应,来考虑钠与乙醇的反应,将盐酸、水以及乙醇都视作一元酸进行处理,先考虑钠与盐酸、与水的反应情况,再考虑钠与乙醇的反应。

如图-2,钠与盐酸反应时,HCl作为一元酸,1分子HCl电离出1个H+,产生1分子H2需要2个H+,所以2HCl与2Na反应产生1分子的H2。类似地考虑钠与水的反应,因为水作为弱电解质,1分子H2O电离产生1个H+,所以可以将水视作一元酸来考虑化学方程式的情况。

在考虑钠与乙醇的反应时,也可以将乙醇视作一元酸,所以反应分两步进行,第一步乙醇电离出H+,第二步钠与H+发生氧化还原反应产生H2,如图-3所示。
