知识整合
一、原电池
1.原电池的基本概念
(1)原电池:把化学能转化为电能的装置。
(2)原电池的电极
负极:电子流出——活动性较强——发生氧化反应;
正极:电子流入——活动性较弱——发生还原反应。
(3)原电池的构成条件
①能自发发生氧化还原反应。
②具有活动性不同的两个电极(金属和金属或金属和非金属)。
③形成闭合回路或在溶液中相互接触。
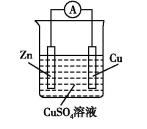
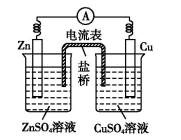
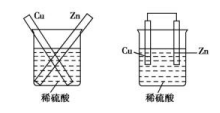
2.原电池的工作原理 (以Zn−Cu原电池为例]
单液原电池 | 双液原电池 | |
装置图 |
|
|
电极与电极反应 | ||
电子流向 | 由锌片沿导线流向铜片 | |
离子迁移方向 | 阴离子向负极迁移;阳离子向正极迁移 | |
电池反应方程式 | ||
两类装置 的不同点 | 还原剂Zn与氧化剂Cu2+直接接触,既有化学能转化为电能,又有化学能转化为热能,造成能量损耗 | Zn与氧化剂Cu2+不直接接触,仅有化学能转化为电能,避免了能量损耗,故电流稳定,持续时间长 |
判断原电池正、负极的五种方法
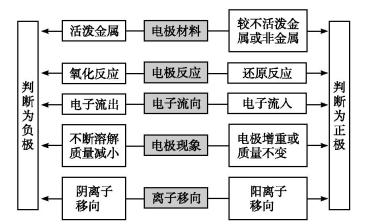
注意:原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定式。
注意:
(1)一般条件下,较活泼的金属材料作负极,失去电子,电子经外电路流向正极,再通过溶液中的离子形成的内电路构成环路。
①在原电池中,电极可能与电解质反应,也可能与电解质不反应;不发生反应的可看作金属发生吸氧腐蚀,如图所示。
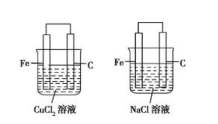
②闭合回路的形成也有多种方式,可以是导线连接两个电极,也可以是两电极接触,如图所示。
(2)在原电池中,电流流动方向与电子流动方向相反。
(3)原电池的判定:一看有无外接电源,若有外接电源则为电解池,若无外接电源则可能为原电池;二看电极是否用导线相连并与电解质溶液形成闭合电路;三看电极与电解质溶液是否能发生自发的氧化还原反应。[来源:学科网ZXXK]
3.原电池电极反应式的书写
(1)准确判断原电池的正负极是书写电极反应的关键。
如果原电池的正负极判断失误,电极反应式的书写一定错误。判断正负极的方法不是绝对的,例如铜片和铝片同时插入浓硝酸溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为:
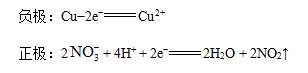
再如镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为:
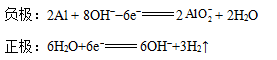
(2)要注意电解质溶液的酸碱性。
在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有酸式和碱式,在酸溶液中,电极反应式中不能出现OH−,在碱溶液中,电极反应式中不能出现H+,像CH4、CH3OH等燃料电池,在碱溶液中碳(C)元素以离子形式存在,而不是放出CO2气体。
(3)要考虑电子的转移数目。
在同一个原电池中,负极失去电子数必然等于正极得到的电子数,所以在书写电极反应时,一定要考虑电荷守恒。防止由总反应方程式改写成电极反应式时所带来的失误,同时也可避免在有关计算中产生误差。
(4)要利用总的反应方程式。
从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总反应方程式。所以只要知道总反应方程式和其中一个电极反应,便可以写出另一个电极反应方程式。
注意:介质对电极反应式书写的影响
①中性溶液反应物若是H+得电子或OH−失电子,则H+或OH−均来自于水的电离。
②酸性溶液反应物或生成物中均没有OH−。
③碱性溶液反应物或生成物中均没有H+。
④水溶液中不能出现O2−。
二、原电池原理的应用
原电池原理在工农业生产、日常生活、科学研究中具有广泛的应用。
化学电源:人们利用原电池原理,将化学能直接转化为电能,制作了多种电池。如干电池、蓄电池、充电电池以及高能燃料电池,以满足不同的需要。在现代生活、生产和科学研究以及科学技术的发展中,电池发挥的作用不可代替,大到宇宙火箭、人造卫星、飞机、轮船,小到电脑、电话、手机以及心脏起搏器等,都离不开各种的电池。
加快反应速率:如实验室用锌和稀硫酸反应制取氢气,用纯锌生成氢气的速率较慢,而用粗锌可大大加快化学反应速率,这是因为在粗锌中含有杂质,杂质和锌形成了无数个微小的原电池,加快了反应速率。
比较金属的活动性强弱:一般来说,负极比正极活泼。
防止金属的腐蚀:金属的腐蚀指的是金属或合金与周围接触到的气体或液体发生化学反应,使金属失去电子变为阳离子而消耗的过程。在金属腐蚀中,我们把不纯的金属与电解质溶液接触时形成的原电池反应而引起的腐蚀称为电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀:在潮湿的空气中,钢铁表面吸附一层薄薄的水膜,里面溶解了少量的氧气、二氧化碳,含有少量的H+和OH−形成电解质溶液,它跟钢铁里的铁和少量的碳形成了无数个微小的原电池,铁作负极,碳作正极,发生吸氧腐蚀:

电化学腐蚀是造成钢铁腐蚀的主要原因。因此可以用更活泼的金属与被保护的金属相连接,或者让金属与电源的负极相连接均可防止金属的腐蚀。