1.双线桥理解基本概念
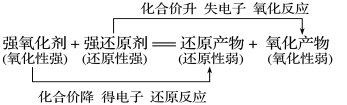
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
2.多种方法判断强弱
(1)金属活动性顺序
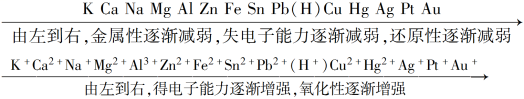
(2)非金属活动性顺序
一般来说,元素非金属性越强,单质越易得到电子,氧化性越强;其对应阴离子越难失电子,还原性越弱。
![]()
(3)依据元素周期律及周期表中元素性质变化规律来判断氧化性、还原性的强弱
同周期,从左至右,核电荷数递增,非金属性逐渐增强,金属性逐渐减弱,单质氧化性逐渐增强,还原性逐渐减弱;
同主族,从上至下,核电荷数递增,非金属性逐渐减弱,金属性逐渐增强,单质氧化性逐渐减弱,还原性逐渐增强。
(4)根据原电池的正负极来判断:
在原电池中,在负极反应的物质还原性一般比作正极物质的还原性强。
3.典型物质判断
(1)典型粒子氧化(或还原)性强弱:
氧化性:Br2>Fe3+>I2>S
还原性:S2->I->Fe2+>Br-
氧化性:Fe3+>Ag+>Cu2+>Fe2+>Zn2+>Al3+
(2)有单质参加的反应或有单质生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化(O2→O3)。
(3)金属阳离子被还原,不一定得到金属单质。如向FeCl3溶液中加入少量Zn,得到Fe2+。
(4)向FeBr2、FeI2的混合物中加入新制氯水,最先被氧化的是I-。
(5)盐酸有酸性、氧化性、还原性;亚硫酸有酸性、氧化性、还原性、漂白性。
(6)Ca(ClO)2溶液中通SO2、FeS+HNO3、Na2SO3+HNO3、Fe(OH)2+HNO3、Fe(OH)3+HI发生氧化还原反应。
(7)氧化还原反应配平:标价态、列变化、求总数、定系数、后检查
一标:标出有变化的元素化合价;
二列:列出化合价升降变化;
三找:找出化合价升降的最小公倍数,使化合价升高和降低的数目相等;
四定:确定氧化剂、还原剂、氧化产物、还原产物的系数;
五平:观察配平其它物质的系数;
六查:检查是否原子守恒、电荷守恒(通常通过检查氧元素的原子数),画上等号。
(8)常见的重要氧化剂、还原剂
氧化剂 | 还原剂 |
活泼非金属单质:X2、O2、S | 活泼金属单质:Na、Mg、Al、Zn、Fe 某些非金属单质: C、H2、S |
高价金属离子:Fe3+、Sn4+ 不活泼金属离子:Cu2+、Ag+其它:[Ag(NH3)2]OH、新制Cu(OH)2 | 低价金属离子:Fe2+、Sn2+ 非金属的阴离子及其化合物: S2-、H2S、SO32- 、I -、HI、NH3、Cl-、HCl、Br-、HBr |
含氧化合物:NO2、N2O5、MnO2、Na2O2、H2O2、HClO、HNO3、浓H2SO4、NaClO、Ca(ClO)2、KClO3、KMnO4、王水(浓盐酸:浓硝酸3:1混合成的酸) | 低价含氧化合物:CO、SO2、H2SO3、Na2SO3、Na2S2O3、NaNO2、H2C2O4、含-CHO的有机物(醛、甲酸、甲酸盐、甲酸某酯、葡萄糖、麦芽糖)等 |
既作氧化剂又作还原剂的有:S、SO32-、HSO3-、H2SO3、SO2、NO2-、Fe2+及含-CHO的有机物。
