SO2/CO2通入氯化钡/氯化钙溶液能不能生成沉淀?
2025-04-26 11:56
来源:
文化之窗
本文影响了:822人
一、SO2通入氯化钡溶液能不能生成沉淀?
假设反应发生了BaCl2+SO2+H2O→BaSO3+2HCl但HCl又会溶解掉BaSO3,或者说盐酸的酸性比碳酸强,所以该反应不能发生。现在从沉淀溶解平衡角度来分析,要生成BaSO3,c(Ba2+)•c(SO32-)=Ksp。但是亚硫酸溶液中,SO2+H2O  H2SO3
H2SO3 H++HSO3-,HSO3-
H++HSO3-,HSO3- H++SO32-,第一步电离微弱电离产生HSO3-,第二步电离产生SO32-更加微弱,所以SO32-浓度很小,达不到Ksp,所以无法形成BaSO3沉淀。
H++SO32-,第一步电离微弱电离产生HSO3-,第二步电离产生SO32-更加微弱,所以SO32-浓度很小,达不到Ksp,所以无法形成BaSO3沉淀。因此,SO2通入到BaCl2溶液中,要产生沉淀:
①加入碱(如NaOH、NH3等),消耗反应生成的酸,这时得到的白色沉淀为BaSO3。
②加入氧化性物质(如Cl2、H2O2、HNO3、Fe3+、O2等),将SO2氧化成SO42-,这时得到的白色沉淀为BaSO4
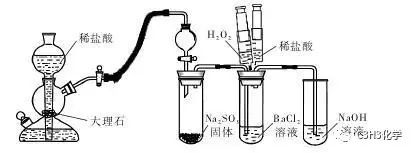
该题中所给的数据,可以计算一下,c(Ba2+)•c(SO32-)大于Ksp,可形成BaSO3沉淀。所以BaCl2溶液与H2SO3溶液混合后出现的白色浑浊中有亚硫酸钡。实验时将二氧化硫通入BaCl2溶液却出现了明显的白色浑浊,这是为什么呢?通过一些老师的实验表明,二氧化硫通入BaCl2溶液是不会发生反应的,然而通常做实验时为什么会出现白色沉淀呢?
二氧化硫与水反应生成亚硫酸,亚硫酸碰到无处不在的O2被氧化成硫酸,这样一来就生成硫酸钡沉淀。通过分液漏斗上口向反应系统内排入CO2气体,就可以保证整个反应系统处于完全无氧氛围中,且操作方便,操作结果如所期望的:当在分液漏斗中加入浓硫酸,产生大量二氧化硫气体进入到BaCl2溶液中,溶液依然清澈透明!滴加双氧水后产生白色沉淀。
参考文献:
1乔月东,关于二氧化硫通入氯化钡溶液有关现象的探究,《化学教学》2007年8期
2于永民等,二氧化硫气体通入BaCl2溶液实验的探究,《化学教学》2012年4期
二、CO2通入氯化钙溶液能不能生成沉淀?
下面题目中有数据,大家估算一下,能不能产生碳酸钙沉淀?
2023浙江1月高考化学
题目:碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:CaCO3(s) ⇌ Ca2+(aq) + CO32–(aq) [已知Ksp(CaCO3) = 3.4×10–9,Ksp(CaSO4) = 4.9×10–5,H2CO3的电离常数Ka1 = 4.5×10–7,Ka2 = 4.7×10–11],A.上层清液中存在c(Ca2+) = c(CO32–)C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变D.通过加Na2SO4溶液,可实现CaCO3向CaSO4的有效转化解析:(这是浙江越州中学吴文中老师的解答过程,摘自《中学化学教学参考》2023年第4期)

![]()