初见2024年全国甲卷第10题,有种“穿越”的恍惚,感觉与当下"无情境不命题"的大行其道有些格格不入啊。本题给出四瓶无色溶液之间的反应关系图,学生需要分析物质之间相互转化的信息,经过逻辑推导和探索归纳得出各无色溶液所代表的物质种类并加以论证。这道题要是放在10年前甚至是20年前,堪称“经典”,既能考查学生对元素化合物知识掌握的熟练程度,又能考查出学生的逻辑推理和判断能力。
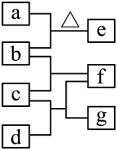
| 试题 | (2024全国甲10)四瓶无色溶液NH4NO3、Na2CO3、Ba(OH)2、AlCl3,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是 A. a呈弱碱性 B. f可溶于过量的b中 C. c中通入过量的e可得到无色溶液 D. b和d反应生成的沉淀不溶于稀硝酸
|
| 答案 | B |
| 解析 | 【分析】由题意及关系图可知,a与b反应需要加热,且产生的e为无色气体,则a和b分别为NH4NO3和Ba(OH)2的一种,产生的气体e为NH3;又由于b和c反应生成白色沉淀f,NH4NO3不会与其他三种溶液产生沉淀,故b为Ba(OH)2,a为NH4NO3;又由于c既能与b产生沉淀f,又能与d反应产生沉淀f,故c为AlCl3,d为Na2CO3,生成的白色沉淀为Al(OH)3,无色气体g为CO2。综上所述,a为NH4NO3溶液,b为Ba(OH)2溶液,c为AlCl3溶液,d为Na2CO3溶液,e为NH3,f为Al(OH)3,g为CO2。 【详解】A.由分析可知,a为NH4NO3溶液,为强酸弱碱盐的溶液,NH4+水解显酸性,故a显弱酸性,A项错误 B.由分析可知,f为Al(OH)3,b为Ba(OH)2溶液,Al(OH)3为两性氢氧化物,可溶液强碱,故f可溶于过量的b中,B项正确; C.由分析可知,c为AlCl3溶液,e为NH3,AlCl3溶液通入NH3会生成Al(OH)3沉淀,Al(OH)3不溶于弱碱,继续通入NH3不能得到无色溶液,C项错误; D.由分析可知,b为Ba(OH)2 ,d为Na2CO3,二者反应生成BaCO3沉淀,可溶与稀硝酸,D项错误; 故选B。 |
无独有偶,翻看今年的江西卷,也看到类似的身影。
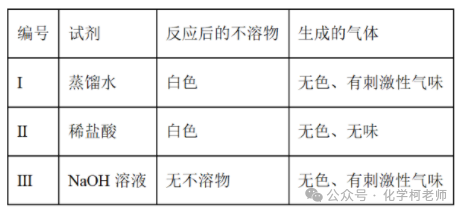
| 试题 | 白色固体样品X,可能含有AgNO3、NH4NO3、BaCl2、KCl、Na2SO3、Na2CO3、Al2O3之中的几种或全部。在三个烧杯中各加入适量X。分别加入足量以下三种试剂并微热使之充分反应,实验记录为:
依据实验现象,下列说法正确的是 A. 可能含Al2O3 B. 含BaCl2 C. 含Na2SO3 D. 不含KCl |
| 答案 | A |
| 解析 | 【分析】白色固体样品X,可能含有AgNO3、NH4NO3、BaCl2、KCl、Na2SO3、Na2CO3、Al2O3之中的几种或全部,在三个烧杯中各加入适量X,分别加入足量以下三种试剂并微热使之充分反应,Ⅰ.加入蒸馏水,微热生成无色有刺激性气味的气体,是微热条件下铵根离子和弱酸根离子发生的双水解反应生成了氨气和气体,说明一定含NH4NO3,反应生成白色沉淀,白色沉淀可能为氧化铝,也可能为AgNO3和Na2SO3、Na2CO3反应生成的Ag2SO3或Ag2CO3沉淀,或BaCl2和Na2SO3、Na2CO3反应生成的BaSO3、BaCO3沉淀,Ⅱ.加入稀盐酸反应后的不溶物为白色沉淀,同时生成的气体为无色无味气体,为二氧化碳气体,说明一定含Na2CO3,一定不含Na2SO3,白色沉淀可能为AgNO3生成的AgCl,可能含AgNO3、BaCl2,可能存在Al2O3;Ⅲ.加入NaOH溶液,无沉淀,有无色刺激性气味的气体生成,说明一定含NH4NO3,可能含AgNO3、BaCl2、KCl、Na2SO3、Na2CO3、Al2O3,据此分析判断。 【详解】A.分析可知,可能含Al2O3,故A正确; B.分析可知,固体中可能含BaCl2,故B错误; C.加入盐酸生成气体为无色无味,说明不含Na2SO3,故C错误; D.上述过程中的分析可知,KCl的存在不能确定,故D错误; 故选A。 |
肯定不会像有些老师说的“现在高考题没得出了,又把以前的题翻出来晒一晒接着出”,也不见得每道题都要披上情境的“外衣”,不管高考题的形式怎么变,但考查思维的“内核”不会变。像这种有很好区分度的经典好题,永远不会“过时”!
笔者也尝试命制一道这样的“经典”题,以飨读者。不妥之处,敬请批评指正!
| 试题 | 强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同)。已知:① 甲溶液分别与其它三种溶液混合,均产生白色沉淀;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是 A. 四种物质中一定有共价化合物 B. 四种物质中一定有Ba(OH)2 C. 丙溶液中含有NH4+ D. 丁溶液中含有HCO3- |
| 答案 | C |
| 解析 | 【分析】由②中信息可知乙为H2SO4;再结合① 中信息可知,甲溶液中一定含有Ba2+,由于这些离子结合产生的白色沉淀只可能是Mg(OH)2、BaSO4、BaCO3中的一种,所以甲溶液中的阴离子一定是OH-,即甲为Ba(OH)2。由③中信息可知,丙中含有的阴离子是Cl-,那么阳离子只能是Mg2+才能满足①中条件,故丙为MgCl2,丁为NH4HCO3。据此分析判断。 【详解】A.由②中信息可知乙为H2SO4,H2SO4是共价化合物,故A正确; B.分析可知,甲为Ba(OH)2,故B正确; C.分析可知,丙为MgCl2,故丙溶液中不含NH4+,故C错误; D.分析可知,丁为NH4HCO3,故丁溶液中含有HCO3-,故D正确; 故选C。 |