原电池中电子是如何开始移动的?
首先介绍两类原电池,一类是电极材料不同的原电池;一类是材料相同,但是会通入不同气体的(氢氧)燃料电池。
一、第一类电池,以硫酸,铜棒(正极)和锌棒(负极)构成的世界上最早的伏打电池为例。
首先,两个金属电极都有自由电子,这些电子都想挣脱金属离子的束缚,成为真正自由电子,大多数电子被金属离子约束了,但有少量电子仍然从导线的一端移向另一端。 那么电子是互相流动的吗?就是铜的电子流向锌,同时锌的电子流向铜极?事实上是不会的,不一样的金属电极有不一样的电动势,从物理学而言电子沿着电势增大的方向移动,铜的电势高,所以电子从锌极流向铜极。不过化学到底是研究微观粒子的,从化学的微观角度其实更能理解,因为锌的活泼性大于铜,因此更容易失去电子,一些微量的电子开始向铜极移动。
同时,还存在着另一个事实,这与金属在溶液中的状况有关。当一种金属浸入溶液中,由于电子不能在水中移动,金属原子受水分子的作用,有解离成金属的水合离子并进入水中的趋势,留下了自由电子。金属越活泼越容易发生这样的反应。如果金属浸入的是对应的盐溶液,盐溶液的浓度越低,出现水合离子的趋势也越大。这些积累的自由电子也会因为两极的电势差而向不活泼的那一极移动 。 在铜锌原电池中,因锌比铜活泼,在上述过程中,锌电极积累的电子程度更大,锌片上留下的电子要比铜片多,锌电极的电势要比铜极低。当用导线将两电极相连后,电子将从锌电极向铜电极。 接下来就是溶液中的阳离子会被铜电极上聚集起来的电子吸引,而移动到铜电极附近,并获得电子。比如伏打电池中,硫酸中的氢离子移向铜极,在电极的表面获得电子,转化为氢原子,并进一步结合成氢气,当表面附着的氢气达到一定的量时,它们离开体系逸出,导致电子缺失,吸引更多的电子从锌极移动过来,至此,外电路的电子负着负电荷向正极移动,内电路溶液中带负电的阴离子向负极移动,回路形成,电池可以工作了。 一般高中实验室会用多孔的石墨电极储存氢气和氧气,然后在硫酸介质中产生能使二极管发光或电流表指针转动的电流。在实际应用中,燃料电池的两极均为铂电极,氢气通过管道到达铂电极后在铂(Pt)的催化下,转化为两个氢离子和电子:电子通过导电载体在外电路趋向正极,氢离子(质子)通过离聚物也趋向正极。而正极的氧气得到电子,与传递过来的氢离子结合转化为水。因此合适的催化剂在实际过程中非常重要,这样才能在最短的时间里获得最大的电流。
既然带电微粒定向移动就能产生电流,那么如果让溶液中的离子定向移动起来,也能形成电流,就是浓差电池。 浓差电池有两种类型,分为电极浓差电池和溶液浓差电池。电极浓差电池是指两个电极的材料相同,但浓度不同;而溶液浓差电池则是电解质溶液的浓度不同。 pH笔就是一种电极浓差电池(如图1)。是基于玻璃电极和氢离子选择性电极之间的电势差。当溶液中的氢离子浓度发生变化时,玻璃电极和氢离子选择性电极之间的电势差也会随之改变。通过测量这个电势差,就可以计算出溶液的pH值。 ①玻璃电极:玻璃电极是pH计的核心部件,主要由一个玻璃管和一个金属球组成。玻璃管内装有溶液,金属球与玻璃管之间有一个特殊的玻璃膜,。它对氢离子有选择性响应。当玻璃电极浸入溶液中时,氢离子会与玻璃膜表面的某些离子发生交换,从而在玻璃膜两侧产生电位差。这个电位差与溶液中氢离子浓度的对数(即pH值)呈线性关系。
②氢离子选择性电极:氢离子选择性电极是一个由特殊材料制成的半透膜,可以允许氢离子通过,而阻止其他离子通过。当溶液中的氢离子浓度发生变化时,氢离子选择性电极内部的电势差也会随之改变。
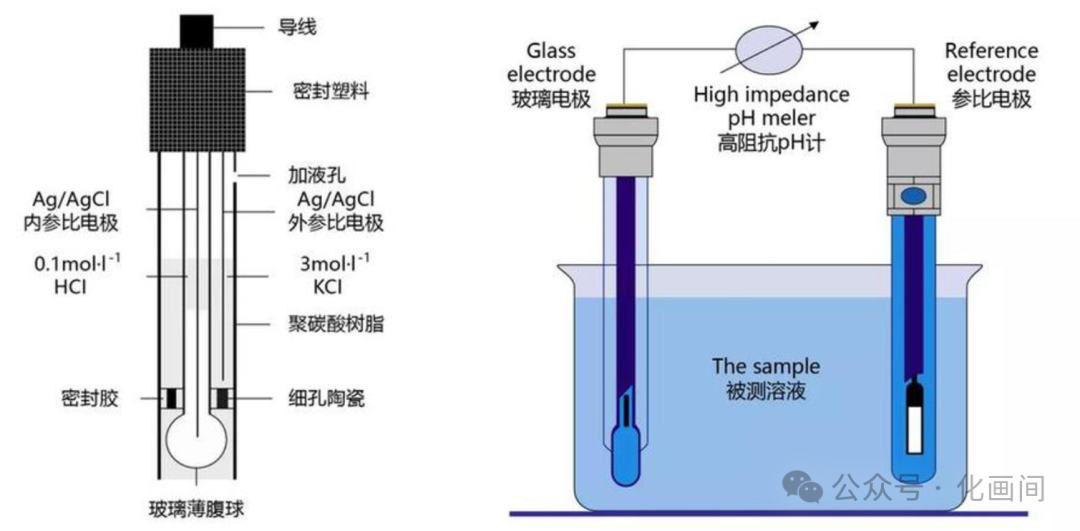
图1 pH计的内部结构及工作原理示意图(图源:科研必备“武器”之pH计 )
以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池(见图2),pH与电池的电动势E存在关系:
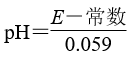
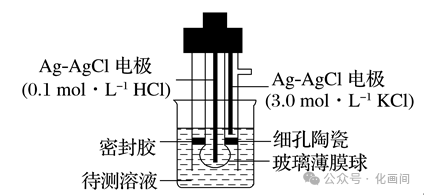
图2 pH计使用
玻璃薄膜球内电极的电势低,则该电极为负极,上面将聚集更多带负电的离子,并将电子输送给外电路。同时,玻璃膜内外氢离子浓度的差异会引起电动势的变化,分别测定含已知pH的标准溶液和未知溶液的电池的之间的电动势,可得出未知溶液的pH。pH计工作时,还利用原电池原理,将化学能转化为电能。
如图3所示,就是将两个完全相同的铜片分别放入体积相同、浓度不同的CuSO4溶液中形成的浓差电池。当两极附近电解质溶液浓度相等时停止放电。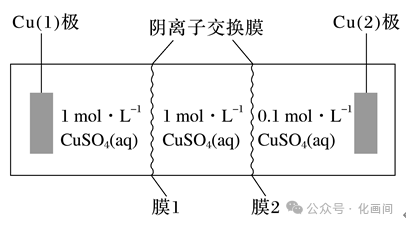
图 3
我们从图中可以发现Cu(1)极附近硫酸铜溶液浓度大于Cu(2)极,所以Cu(1)极的电解质溶液浓度降低,离子会从浓度大的向浓度小的扩散,由于设置了阴离子交换膜,即只允许SO42-向Cu(2)极移动,因此(2)区将聚集大量阴离子,Cu(2)极为负极,发生氧化反应,电极反应为Cu-2e-===Cu2+,有电子将从Cu(2)极流向Cu(1)极。Cu(1)极的电极反应式为Cu2++2e-===Cu,为了维持电荷平衡,SO42-通过膜1向右迁移;理论上两膜之间的硫酸铜溶液浓度保持不变,当正、负两极硫酸铜溶液浓度均为0.55 mol·L-1时,该电池停止放电。

![]()


