一、金属元素知识的“不一定”
1.金属元素在化合物中不一定只表现1种价态。如在Fe3O4中铁元素表现+2、+3价2种价态。
2.活泼的金属元素与活泼的非金属元素所形成的化合物不一定是离子化合物。如AlCl3是共价化合物。
3.金属元素不一定只具有还原性或氧化性。如+2价的铁元素(Fe2+)既具有氧化性又具有还原性。
4.金属元素不一定不能发生歧化反应。如在酸性溶液中+1价的铜元素(Cu+)能够发生歧化反应,即:
2Cu + = Η + Cu+Cu 2+
5.碱金属元素在化合物中不一定只能表现+1价。如锂元素有+3价化合物(如Li2O3)。
二、金属单质知识的“不一定”
1.金属单质形成的晶体不一定都是金属晶体。如金属锗晶体属于共价晶体。
2.常温下,金属单质不一定都是固体。如金属汞是液体。
3.铁与卤素单质反应不一定都生成三卤化铁(FeX3)。Fe分别与F2、Cl2和Br2反应,分别生成FeF3、FeCl3和FeBr3,但Fe与I2反应只能生成FeI2。
4.金属单质与盐溶液的反应不一定属于置换反应。如反应
均不属于置换反应。
5.铁与强氧化性酸反应不一定生成+3价铁盐。如过量的Fe分别与浓硝酸、稀硝酸反应均生成+2价铁盐,其化学方程式分别为:
![]()
6.铁制容器和铝制容器不一定不能盛装酸溶液。如铁制容器和铝制容器均能够盛装浓硫酸和浓硝酸。
7.金属性弱的金属不一定不能置换出金属性强的金属。如工业上用钠制钾的原理为:
这是因为该反应是可逆反应,而K的熔、沸点比Na低,产生的钾蒸气脱离平衡体系,使平衡右移,所以该置换反应能够发生。
8.碱金属单质与氧气反应不一定都能生成过氧化物。如Li与氧气反应只能生成Li2O。
9.碱金属单质不一定都能保存在煤油中。如金属锂不能保存在煤油中,这是因为锂的密度(0.53 g/cm3)比煤油的密度(0.80 g/cm3)小。
10.碱金属单质在空气中燃烧时不一定只发生与氧气的反应。如锂在空气中燃烧时,既能与氧气发生反应,又能与氮气发生反应。
三、金属离子或含金属元素的离子知识的“不一定”
1.金属元素不一定不能形成阴离子。
如MnO-4、MnO 4 2- 、AlO-2、ZnO 2 2- 、CrO 4 2- 、Cr2O 7 2- 等阴离子中均含有金属元素。
2.含金属元素的离子不一定都是阳离子。
如MnO-4、MnO 4 2- 、AlO-2、ZnO 2 2- 、CrO 4 2- 、Cr2O 7 2- 等均为阴离子。
3.金属阳离子被还原不一定得到金属单质。
如Fe3+可被还原为Fe2+。
四、金属化合物知识的“不一定”
1.金属氧化物不一定是碱性氧化物。
如Mn2O7、CrO3是酸性氧化物,Al2O3、ZnO是两性氧化物,Na2O2、K2O2是过氧化物。
2.卤化银(AgX)不一定都有感光性,见光不一定都会分解。AgCl、AgBr和AgI都有感光性,见光都会分解,但AgF无感光性,见光不会分解。
3.卤化银(AgX)不一定都难溶于水。AgCl、AgBr和AgI都难溶于水,但AgF易溶于水。
4.碱与碱不一定不能发生反应。如Al(OH)3与NaOH溶液、Zn(OH)2与NaOH溶液、Cu (OH)2与NH3·H2O均能够发生反应,其化学方程式分别为:
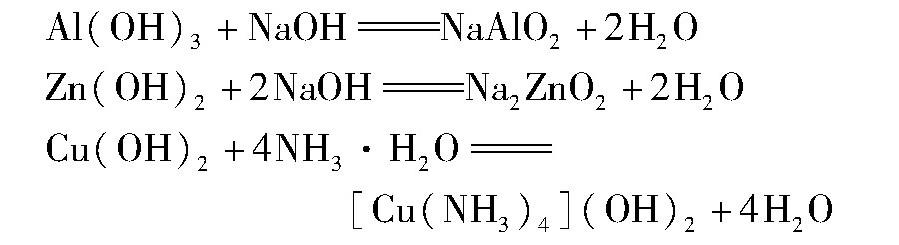
5.Na2O2所参加的反应不一定都有O2放出。如Na2O2与SO2的反应为:
![]()
6.碳酸盐(正盐)的溶解度不一定小于其酸式盐的溶解度。如溶解度:Na2CO3>NaHCO3。
7.碱与酸的反应不一定属于复分解反应。如Fe(OH)3与HI的反应、Fe(OH)3与H2S的反应、Fe(OH)2与稀HNO3的反应均属于氧化还原反应均不能发生复分解反应。
8.盐与碱反应不一定生成新盐和新碱。如
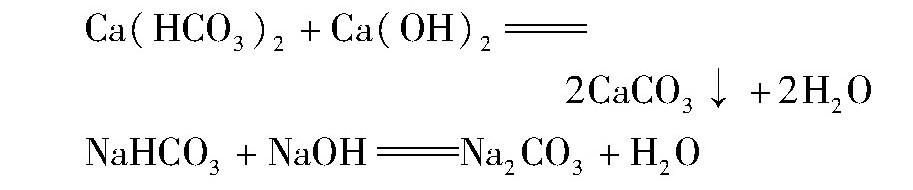
9.盐与盐反应不一定生成2种新盐。如AlCl3溶液与Na2CO3溶液、AlCl3溶液与Na2S溶液均发生双水解反应,不生成2种新盐。
10.盐与酸反应不一定生成新盐和新酸。如KMnO4与浓盐酸、NaClO与氢碘酸均发生氧化还原反应,其化学方程式分别为:
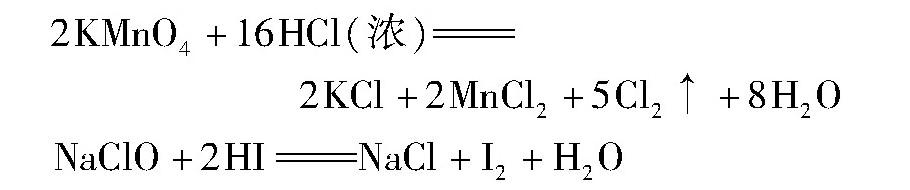
11.金属氧化物与酸的反应不一定属于复分解反应。如FeO与稀HNO3的反应、Fe3O4与稀HNO3的反应、Fe2O3与HI的反应、Fe3O4与HI的反应、FeO与浓H2SO4的反应、Fe3O4与浓H2SO4的反应及MnO2与浓盐酸的反应均属氧化还原反应,均不能发生复分解反应。



