常说化学反应的本质是竞争,条件占优则主要进行。以下两个反应则体现的淋漓尽致。
一、Fe3+和SO32-的反应探究
1、结论:
Fe3+和SO32-间相互促进的水解反应和氧化还原反应在同一反应体系中共存并相互竞争。
①反应一开始,由于相互促进的水解反应反应速率较快,溶液迅速呈现红褐色。
②随着反应的进行,作为相对能进行彻底的氧化还原反应不断地消耗铁离子与亚硫酸根离 子 ,使水解反应的平衡发生了逆向移动;
③最终随着时间的推移,在竞争过程中氧化还原反应占据了主导。
其中定量实验5进行20min时,该铁离子与亚硫酸根离子的反应体系中氧化还原反应进行程度达到了91.50%,相互促进的水解反应进行程度只有8.50%。在竞争过程中氧化还原反应逐渐占据了主导地位。
2、实验证明:
实验1: 先向小试管中加入两滴管 0.50mol/L的 FeCl3溶液, 再加入两滴管0.50mol/LNa2SO3溶液,振荡后观察现象 。
实验现象:试管中溶液颜色加深,由棕黄色变为红褐色(见图1)。
实验2 : 取上述反应后的溶液,用激光笔从侧面照射溶液。
实验现象:溶液中出现红色光路(见图2)。
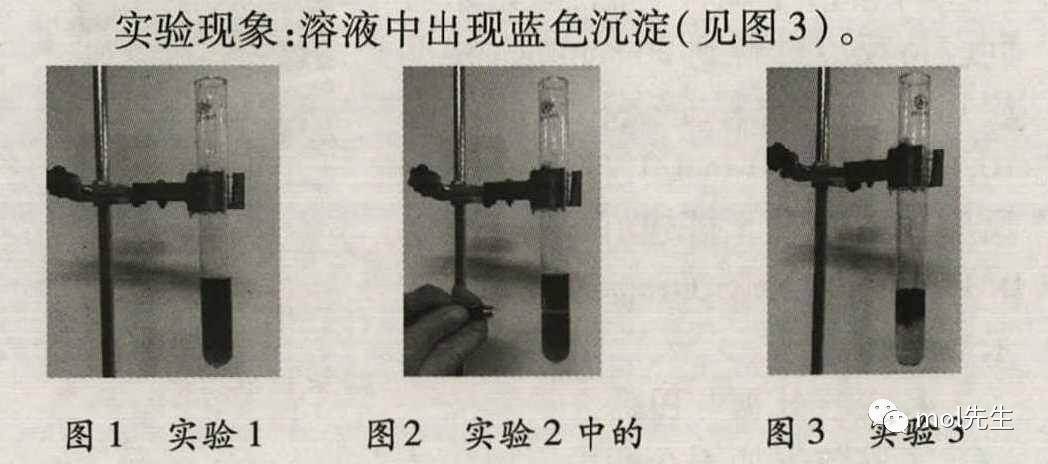
实验3:取上述反应后溶液少许溶于试管中,加入少量蒸馏水稀释,再向稀释后的溶液中滴加几滴K3[Fe(CN)6]溶液 。
实验现象:溶液中出现蓝色沉淀(见图3)。
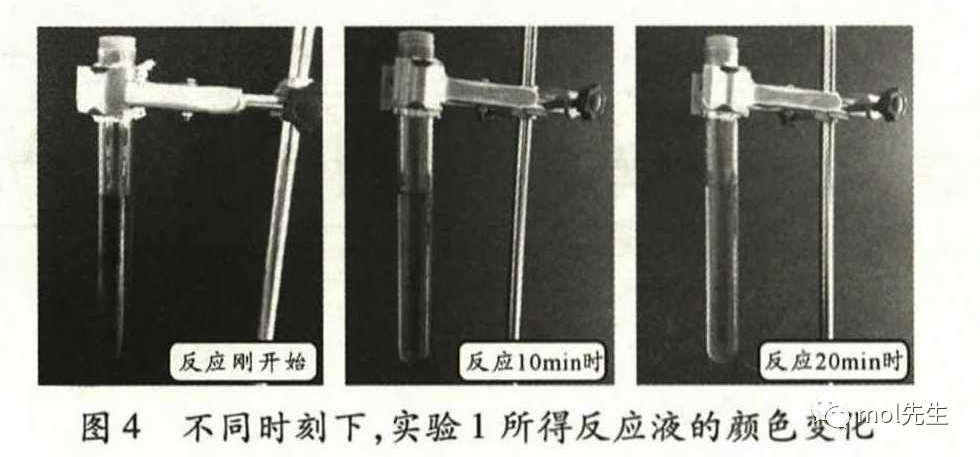
实验4:将上述反应后的溶液放置一段时间后,观察到溶液的颜色由一开始的红褐色逐
渐变浅,大约在20min 后,溶液呈现浅黄色(见图4)。
实验5:向20.00 ml 0.10mol/LFeCl3溶液与10.00ml0.10mol/LNa2SO3溶液反应20min后的溶液中,先加入10.00ml 0.10mol/L的I2溶液充分反应,再用0.10mol/LNa2SO3标准液滴定剩余的碘液,测定溶液中未被氧化的+4价硫元素(H2SO3、SO32-、HSO3-)的含量。
(2022·东莞中学松山湖学校月考)手持技术(Handheld Technology)是由计算机和微电子技术相结合的新型数字化实验手段。向FeCl3溶液中加入Na2SO3溶液,控制不同3(2-)n(Fe3+)())时,利用手持技术测量其与溶液pH和电导率的关系如图所示。已知:
ⅰ.a点时溶液澄清透明,加入NaOH溶液产生灰绿色难溶物。
ⅱ.b点出现明显红褐色难溶物,取上层清液,分出两等份,分别加入KSCN溶液和NaOH溶液,前者溶液变为红色,后者无灰绿色难溶物。
结合以上信息,下列分析不合理的是( )
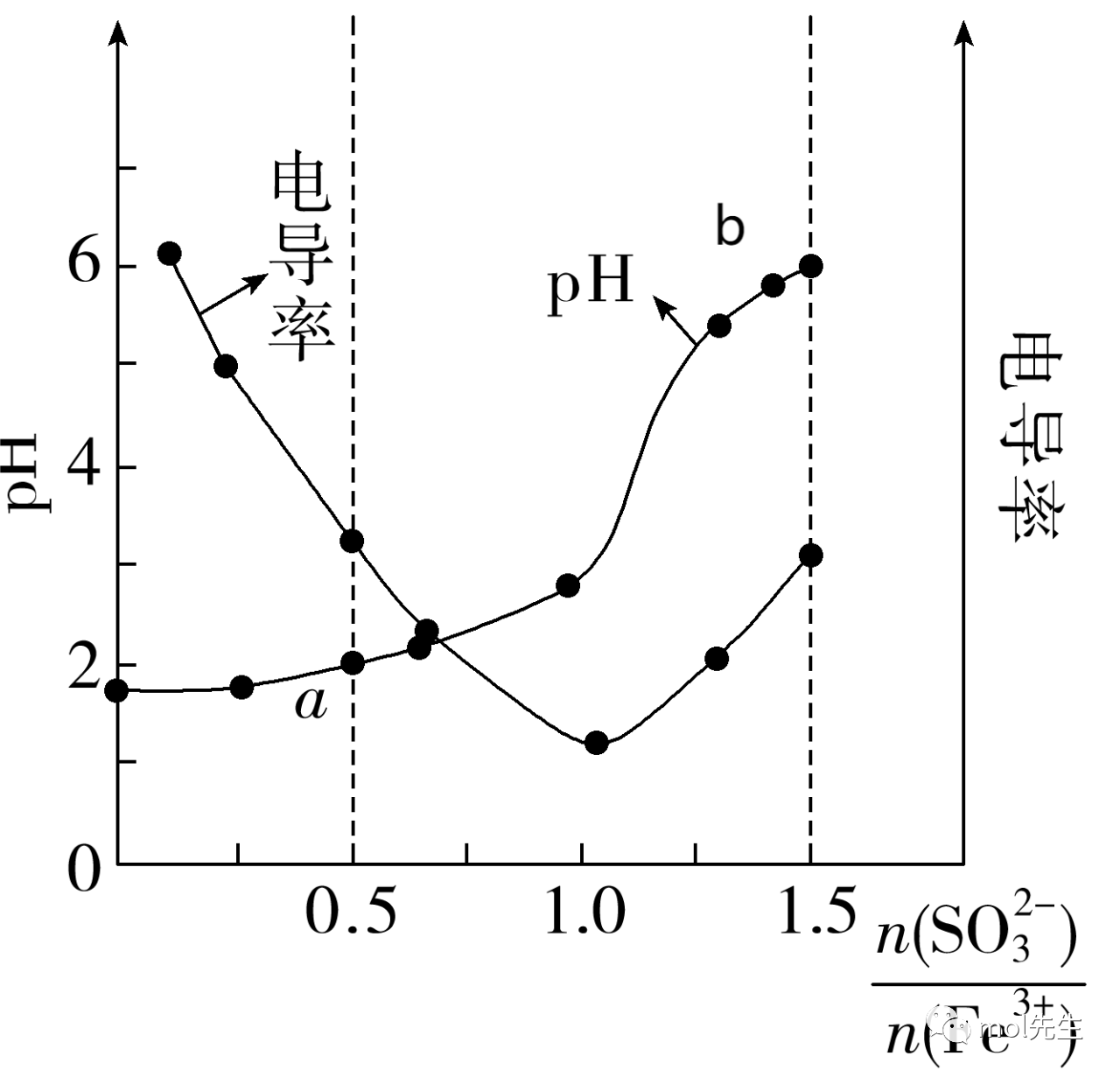
A.a点时主要反应的离子方程式为2Fe3++SO3(2-)+H2O===2Fe2++SO4(2-)+2H+
B.溶液电导率最低时,离子浓度和最小
C.b点时Fe3+和SO3(2-)主要发生相互促进的水解反应
D.混合后溶液的pH决定FeCl3和Na2SO3主要反应的反应类型
解析:A项,a点时,溶液澄清透明,加入NaOH溶液产生灰绿色难溶物Fe(OH)2与Fe(OH)3的混合物,证明a点时Fe3+与SO3(2-)发生了氧化还原反应:2Fe3++SO3(2-)+H2O===2Fe2++SO4(2-)+2H+;B项,b点时出现了明显红褐色难溶物Fe(OH)3,上层清液分别加入KSCN溶液和NaOH溶液,前者溶液变为红色,含Fe3+,后者无绿色难溶物,无Fe(OH)2生成,说明b点主要发生Fe3+与SO3(2-)的水解互促作用,2Fe3++3SO3(2-)+6H2O===2Fe(OH)3+3H2SO3,由此可知3(2-)n(Fe3+)())=1.5,即b点时溶液中离浓度和最小,此时电导率不是最低;C项,由上述分析知,b点主要发生Fe3+与SO3(2-)的水解互促作用;D项,由图及上述分析知,混合后溶液的pH,决定Fe3+和SO3(2-)主要反应类型,以氧化还原反应为主时溶液pH低,以水解互促反应为主时,溶液的pH升高。
答案:B
二、Fe3+和S2-的反应探究
1、结论:
①生成黑色Fe2S3的沉淀反应是动力学优势反应,生成Fe2+和S的氧化还原反应是热力学优势反应;
②发现Fe2S3可以与Fe3+反应生成S和Fe2+,
③Fe2S3 在酸性条件下不稳定,会转变成Fe2+、S和H2S;
④在弱碱性条件下,Fe3+也有与HS-发生氧化还原反应的倾向;
⑤Fe3+在水溶液主要以水解产物[Fe(H2O)6-n(OH)n](3-n)+(n=1,2)存在, [Fe(H2O)6-n(OH)n](3-n)+的氧化性很弱,难以将H2S或HS-氧化,却易与S2-结合生成ksp极小的Fe2S3沉淀。
2、实验细节:
实验中开始生成的黑色沉淀是Fe2S3。
浓FeCl3溶液与较多量浓Na2S溶液反应时,在振荡过程中有时局部也有少许红褐色沉淀出现,说明过程中局部发生了Fe3+ 和 S2-的双水解反应。但静置后,试管底部只沉积有黑色沉淀。说明即使反应过程生成了少量的Fe(OH)3沉淀也会最终转化为Fe2S3沉淀。
当 Na2S过量时,在生成黑色Fe2S3沉淀的同时也生成了少量的硫单质。由于硫单质颜色很浅被Fe2S3浓浓的黑色掩盖住了,难以观察。硫单质的生成说明,在Na2S过量时,溶液中也发生了(或是局部发生了)氧化还原反应,生成Fe2+ 和 S,Fe2+ 与过量的 S2-结合生 成FeS沉淀,所以黑色沉淀中也应有FeS沉淀。
将上述Fe2S3黑色沉淀过滤出来,洗涤干净。取少量置于一支试管中,加入FeCl3溶液,黑色沉淀逐步转变成淡黄色的硫沉淀。Fe2S3和 FeS均可与FeCl3溶液反应,反应为
Fe2S3 +4Fe3+ =6Fe2+ +3S↓,
FeS+2Fe3+ =3Fe2+ +S↓。
