下划线内容高频考点
一、催化剂
1.过氧化氢溶液在常温下能缓慢分解成水
和氧气,把带火星的木条伸入盛有过氧化氢溶液的试管中,
带火星的木条不能复燃,因为过氧化氢溶液分解很慢,放出的氧气很少。
在过氧化氢溶液中加入少量二氧化锰,把带火星的木条伸入试管,
溶液中产生气泡,木条复燃,因为过氧化氢溶液中加入少量二氧化锰,使其分解加速。
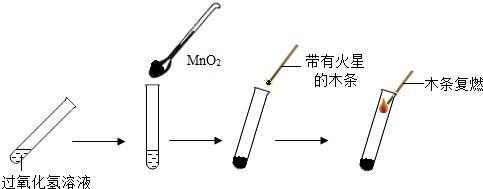
过氧化氢溶液中加入少量二氧化锰
待上述试管中没有现象时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,
溶液中产生气泡,木条复燃,说明氧气是过氧化氢产生的,
二氧化锰只起加快产生氧气的作用。
2.在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有
发生变化的物质叫作催化剂(又叫触媒)。催化剂在化学反应中所起的作用叫催化作用。硫酸
铜溶液、红砖粉末等对过氧化氢的分解也具有催化作用。
注意:①同一反应可以有不同的催化剂。
②催化剂不能改变生成物的质量。
③二氧化锰不是专做催化剂用的,如:分解高锰酸钾制取氧气时,二氧化锰是生成物。
3.催化剂特点:
a.能够改变反应速率,不能改变生成物的质量;
b.反应前后质量不变;
c.反应前后化学性质不变
二、氧气的制法
1.工业上制取氧气:根据液态氮和液态氧的沸点不同,由于液态氮的沸点比液态氧的沸点低,氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧了。(物理变化)
2.实验室制取氧气的原理:
⑴在二氧化锰催化下分解过氧化氢
⑵在二氧化锰催化下加热分解氯酸钾
⑶加热分解高锰酸钾
3.如何区分氯酸钾和氯化钾?分别取两种固体粉末适量放入试管中,并加入少量的二氧化锰,用酒精灯加热,并分别将带火星的木条伸入试管中,若带火星的木条复燃,则试管中固体粉末为氯酸钾,若带火星木条无明显变化,则试管中的固体粉末为氯化钾。
4.过氧化氢或高锰酸钾分解制取氧气的方法,具有反应快、操作简便、便于收集等优点,但成本高,无法大量生产,只能用于实验室中。工业生产则需考虑原料是否易得、价格是否便宜、成本是否低廉、能否大量生产以及对环境的影响等。
5.某同学制得的氧气不纯,你认为可能的原因有哪些?
⑴没等装置中的空气排干净便开始收集氧气;
⑵排水集气时,集气瓶中的水没有完全充满,还留有气泡;
⑶收集完气体后,玻璃片与集气瓶口之间密封不好;
⑷用向上排空气法收集氧气,时间不够。
6.如何检验一瓶气体是否是氧气?
将带火星的木条伸入集气瓶内,带火星的木条复燃,则证明收集的气体是氧气。
7.用排空气法收集氧气如何验满?
将带火星的木条放在集气瓶口,带火星的木条复燃,则证明氧气已经收集满。
8.用排水法收集氧气如何知道已经收集满了?
集气瓶口有大气泡冒出
9.能用排水法收集氧气的原因是氧气不易溶于水,且不与水反应
10.能用向上排空气法收集氧气的原因是氧气的密度比空气略大,(且不与空气中的成分发生化学反应)
三.高锰酸钾制取氧气
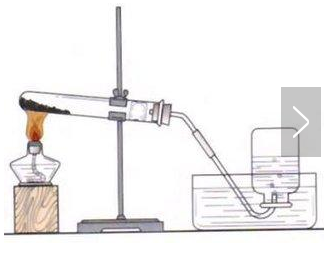
气体制取与收集装置的选择:
发生装置:固固加热型 收集装置:根据物质的密度、溶解性和是否与水反应
⑴仪器:铁架台、酒精灯、试管、单孔胶塞、导管、水槽、集气瓶、玻璃片
⑵操作步骤:(连)-查-装-定-点-收-离-熄(口诀:茶庄定点收利息)
⑶检查装置气密性的方法:连接装置,将导管的另一端伸入水中,用手紧贴容器外壁,稍等片刻,若导管口有气泡冒出,(松手后,导管口部有水柱上升,稍等片刻,水柱并不回落,就说明装置不漏气。)
⑷注意事项及原因:
①试管口略向下倾斜:防止冷凝水回流到热的试管底部,引起试管炸裂。
②药品平铺在试管的底部:使药品均匀受热。
③导管应稍露出橡皮塞:便于气体排出。
④导管口应放一团棉花:防止加热时高锰酸钾粉末进入导管。
⑤排水法收集时,待气泡连续并比较均匀地放出时再收集(刚开始排出的是试管中的空气)
⑥实验结束时,先移导管再熄灭酒精灯:防止水槽内的水倒入进试管,使试管因骤然冷却而炸裂。
⑦用排空气法收集气体时,导管伸到集气瓶底部以便排尽集气瓶内的空气,使收集到的氧气更纯。



