解读一:原料预处理方式

解读二:必考的反应条件
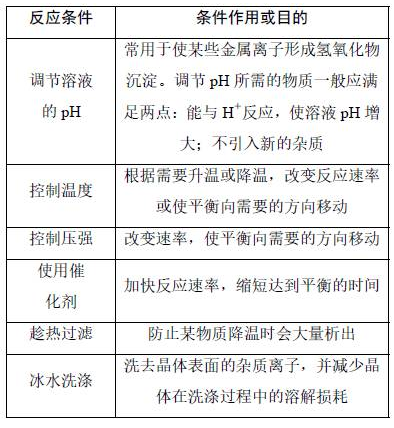
角度三 提纯方法
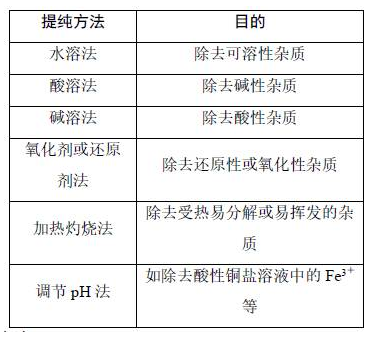
角度四 分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体易液化的特点分离气体,如合成氨工业采用冷却法分离氨气与氮气、氢气。
二、解答无机化工流程题的策略
1.粗读题干,挖掘图示
图示中一般会呈现超出教材范围的知识,但题目中往往会有提示或者问题中不涉及,所以一定要关注题目的每一个关键字,尽量弄懂流程图,但不必将每一种物质都推出,只需问什么推什么。如制备类无机化工题,可粗读试题,知道题目制取什么、大致流程和有什么提示等。
2.携带问题,精读信息
这里信息包括三个方面:一是主干,二是流程图示,三是设置问题。读主干抓住关键字、词;读流程图,重点抓住物质流向(“进入”与“流出”)、实验操作方法等。
3.跳跃思维,规范答题
答题时应注意前后问题往往没有“相关性”,即前一问未答出,不会影响后面答题。要求用理论回答的试题,应采用“四段论法”:改变了什么条件(或是什么条件)→根据什么理论→有什么变化→得出什么结论。
相关练习
1.以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量 分数/% | 2.2~ 2.9 | 2.8~ 3.1 | 22~ 28 | 60~ 65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
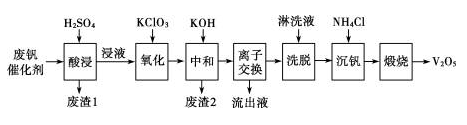
回答下列问题:
(1)“酸浸”时V2O5转化为VO,反应的离子方程式为________________,同时V2O4转化成VO2+。“废渣1”的主要成分是__________。
(2)“中和”作用之一是使钒以V4O形式存在于溶液中。“废渣2”中含有______________________。
(3)“离子交换”和“洗脱”
(4)“流出液”中阳离子最多的是________。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式:________________________。
解析:(1)反应过程中V的化合价不变,所以是复分解反应。注意V2O5在离子方程式中不能拆开;废钒催化剂中,只有二氧化硅不溶于硫酸,成为废渣1的主要成分。(2)中和时,Fe3+、Al3+分别转化为难溶的Fe(OH)3和Al(OH)3,成为废渣2的主要成分。(3)为提高洗脱效率,需使题中所述平衡逆向移动。根据平衡移动原理,碱性越强越有利于平衡逆向移动,所以淋洗液应该呈碱性。(4)经过“离子交换”,钒以R4V4O12形式存在,而铁、铝则在“中和”过程中转化为沉淀,所以“流出液”中最多的阳离子是钾离子。(5)由NH4VO3转化为V2O5,V的化合价未发生变化,该反应为非氧化还原反应,所以N的化合价仍为-3,一种生成物是NH3,另一种生成物必定是H2O。
答案:(1)V2O5+2H+=2VO+H2OSiO2
(2)Fe(OH)3和Al(OH)3(3)碱 (4)K+
(5)2NH4VO3V2O5+2NH3↑+H2O↑
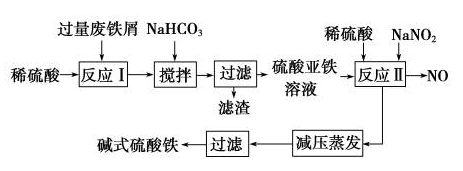
2.(2017·厦门模拟)新型高效絮凝剂Fe(OH)SO4(碱式硫酸铁)常用于污水处理。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图所示:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 时的pH | 2.3 | 7.5 | 3.4 |
完全沉淀 时的pH | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的________沉淀,该工艺中“搅拌”的作用是____________________________。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的[Fe(OH)]2+可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国该药物的相关质量标准,产品中不得含有Fe2+和NO。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填序号)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
解析:(1)稀硫酸浸取废铁屑后所得的溶液中含Fe2+和少量Al3+,根据工艺流程可知该步操作是保留Fe2+,除去Al3+,故加入少量NaHCO3调节溶液pH可以使Al3+沉淀,“搅拌”可以加快化学反应速率。
(2)反应Ⅱ中有NO生成,这说明反应中亚硝酸钠是氧化剂,将亚铁离子氧化生成了铁离子,反应的离子方程式为Fe2++NO+2H+=Fe3++NO↑+H2O;由于要将亚铁离子氧化为铁离子,所以O2与NaNO2在反应中均作为氧化剂;标准状况下11.2 L氧气的物质的量是11.2 L÷22.4 L/mol=0.5 mol,0.5 mol氧气可以得到2 mol电子。亚硝酸钠中氮元素的化合价是+3价,其还原产物中氮元素的化合价是+2价,得到1个电子,所以根据电子守恒可知,相当于是节约了2 mol亚硝酸钠。
(3)[Fe(OH)]2+离子可部分水解生成[Fe2(OH)4]2+聚合离子,则根据电荷守恒可知一定还有氢离子生成,所以该水解反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+。
(4)因产品中含Fe3+,检验Fe2+时不能采用加氯水和KSCN溶液的方法,也不能加NaOH溶液,Fe(OH)3会对检验Fe2+产生干扰;可以用酸性KMnO4溶液检验Fe2+的存在,如含Fe2+,则滴入几滴酸性KMnO4溶液后,溶液紫红色会褪去。
答案:(1)Al3+ 加快化学反应速率 (2)氧化剂 2 mol
(3)2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+(4)D
